こんにちは、知財実務情報Lab. 専門家チームの石川勇介(日本弁理士、元ジェトロ・バンコク事務所)です。
今回は、「東南アジアの用途発明(医薬用途発明)の取り扱い」についてご説明します。東南アジアでは、用途発明(医薬用途発明)を保護対象として認めていない国、保護するための要件が厳しい国が存在します。
1.用途発明、医薬発明とは
日本の特許・実用新案審査基準によれば、「用途発明」とは、ある物の未知の属性を発見し、この属性により、その物が新たな用途への使用に適することを見出したことに基づく発明をいいます(例えば、化合物Xを有効成分として含有する植物Yの成長促進剤)。
また、特許・実用新案審査ハンドブックによれば、医薬発明とは、ある物の未知の属性の発見に基づき、当該物の新たな「医薬用途」を提供しようとする物の発明をいいます。ここで、「医薬用途」とは、(I)特定の疾病への適用、(II)投与時間・投与手順・投与量・投与部位等の用法又は用量が特定された、特定の疾病への適用を意味します。
医薬発明において、化合物Xが初めて医薬として用いられる発明は「第1医薬用途発明」と呼ばれ、その化合物Xについて別の医薬として用いられる発明は「第2医薬用途発明」などと呼ばれています(例えば、化合物Xを有効成分として含有する疾病Z治療剤)。
日本では、用途発明、医薬用途発明を発明の保護対象として認めていますが、東南アジアにおいては、発明の保護対象として認めている国と、認めていない国とがあります。
また、保護対象として認めている国であっても、米国、欧州、中国のように特定のクレーム形式で記載する必要があります。
(例えば、米国:化合物Xを患者に投与することにより疾病Zを治療する方法、欧州:疾病Zを治療するための化合物Xの使用、中国:化合物Xの疾病Z治療剤の調整への応用、などと記載する必要があります)。
今回は、日系企業が東南アジアに進出するにあたっての留意点の一つとして、アセアン主要6カ国(タイ、インドネシア、ベトナム、マレーシア、シンガポール、フィリピン)における「用途発明(医薬用途発明)の保護の取り扱い」について説明します。
2.用途発明、医薬用途発明の保護について
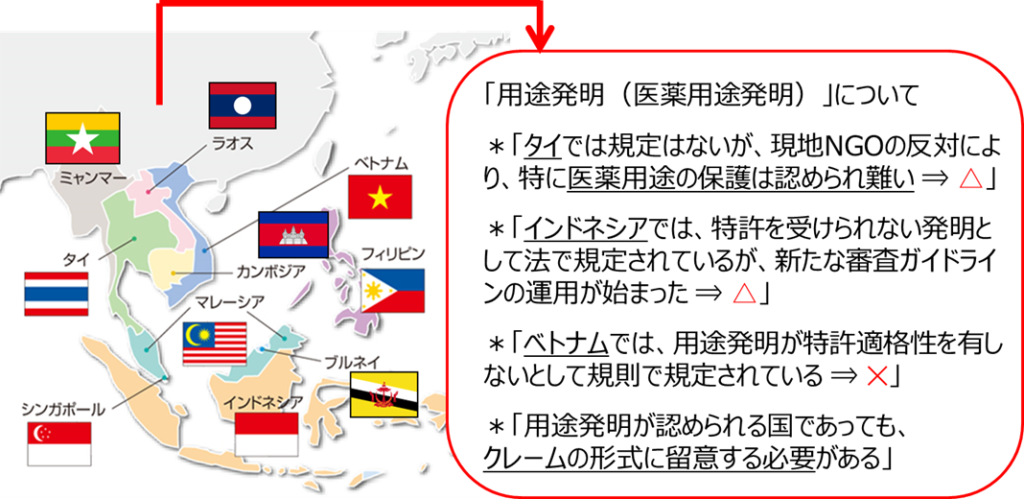
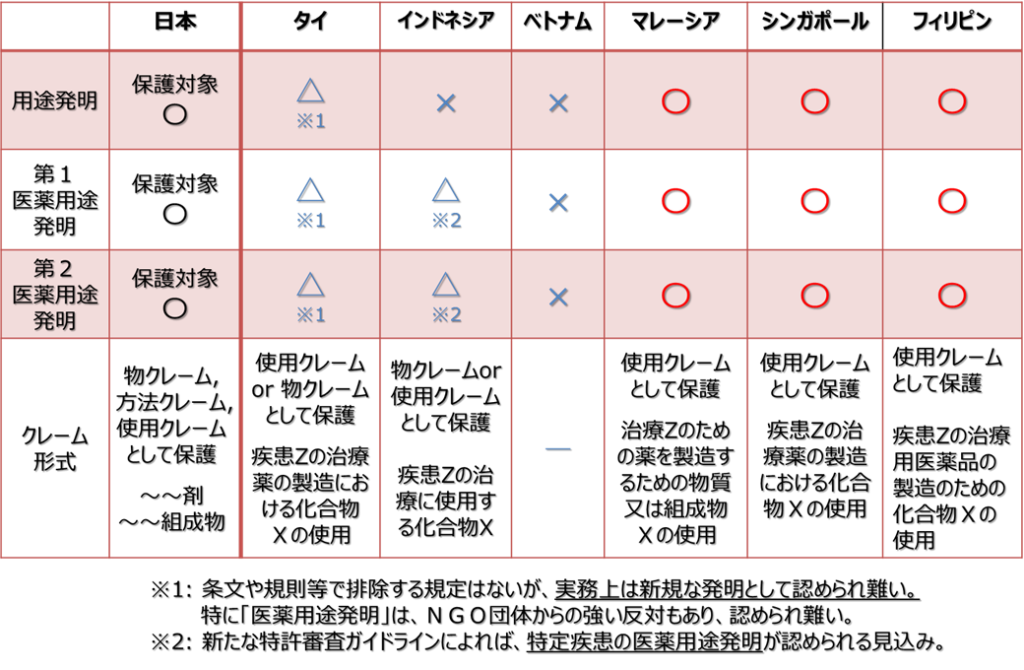
アセアン主要6カ国での「用途発明(医薬用途発明)の取り扱い」について簡単にまとめますと、下記表の通りになります。
なお、「用途発明」は、医薬用途以外の用途発明(素材、化学等の分野に関するもの)を意味するものとし、「第1医薬用途発明」は、公知な物質について初めに医薬用途が見出された発明とします。
アセアン主要6カ国の「用途発明」の取り扱い
(2-1)タイ
タイでは、用途発明の取り扱いについて条文や規則、ガイドライン等で直接言及する記載はありません。現地代理人のヒアリング結果によると、用途発明について「保護される」との意見と「保護されない」との意見とに分かれるようです。しかしながら、実務上は、総じて用途発明については新規な発明として認められ難いこと、特に、医薬用途発明については現地NGO団体(非政府組織)からの強い反対もあって審査が長期化し、認められ難いと聞いています。
なお、タイ特許法第9条には、発明の保護対象とはならないものが列挙されているところ、用途発明(医薬用途発明)について言及はありません。
「第9条」
次の発明は、本法に基づく保護を受けないものとする。
(1)自然発生する微生物及びそれらの成分、動物、植物、又は動物若しくは植物からの抽出物
(2)科学的又は数学的法則及び理論
(3)コンピュータ・プログラム
(4)人間及び動物の疾病の診断、処置又は治療の方法
(5)公の秩序、道徳、健康又は福祉に反する発明
(2-2)インドネシア
インドネシアでは、2016年法改正により、特許法第4条(f)において特許を受けることができない発明として、用途発明(医薬用途発明)が明確に挙げられています。
「特許法第4条」
発明には以下のものを含まない。
(f)以下の発見:
1. 既存の及び/又は既知の製品の新規用法;及び/又は
2. 既存の化合物の新たな形態であって、有意な効能の改善が認められず、その化合物の既知の関連する化学構造との差異がないもの
他方で、現地代理人によれば、インドネシア特許庁は、最近、「新しい特許審査ガイドライン」を発行し、運用開始しているとのことです(公開されていない)。当該ガイドラインによれば、「第1医薬用途発明」について特定の疾患を限定した目的限定型の製品クレーム(疾患Zの治療に使用する化合物X)、使用クレーム(疾患Zの治療のための化合物Xの使用)又はスイス型クレームの形式で記載すること、「第2医薬用途発明」については目的限定型の製品クレームで記載すること、これら医薬用途のサポートとして「各種実験データ」などを示すことで特許性が認められるようです。
上記ガイドラインは、第2医薬用途発明の特許可能性に関して特許法第4条(f)と矛盾すると思われること、そのため実際に特許が付与されるのか、また特許付与後に権利行使した場合に裁判所が特許の有効性についてどのように判断するかについて、現状は不明であるようです。
※上記ガイドラインについて、こちらの現地報告書もご確認ください。
(2-3)ベトナム
2018年1月15日付で施行された通達16/2016/TT-BKHCNにより「ベトナム特許規則」が改正され、第1医薬用途発明、第2医薬用途発明を含めて「用途発明」は特許適格性を有しない(特許として認められない)ことが明確化されました(従来は基準が曖昧な運用がなされていました)。
つまりは、公知物質の新たな用途(医薬用途)は発明の本質的な特徴として考慮されないため、ベトナムでは用途発明ではなく、新規な物質発明として特許の権利化を目指す必要があります。
「知的財産法第4条 用語の解釈」
次の用語は、本法において次の通り理解しなければならない。:
(12)発明とは、自然法則を利用して特定の課題を解決するための、製品又は方法の形態による技術的解決である。
「通達16/2016/TT-BKHCN 25.5(d)(i)」
クレームされた保護対象の機能性・実用性は、その保護対象の本質的な技術的特徴ではなく、その保護対象の目的・その対象から得られた結果にすぎない。
(2-4)マレーシア
マレーシアでは、用途発明、医薬用途発明ともに発明の保護対象として認められています。具体的には、特許法第13条、14条により、「既知の物質又は組成物について新たな用途に係る発明は、それが外科手術若しくは治療による人間又は動物の身体の処置に関する方法や、人間又は動物の身体に施される診断方法における使用であっても、それらの用途の特許性は排除されない」と記載されています。
また、特許審査基準第4章3.5によれば、医薬用途発明についてのクレームの様式について詳細が記載されています。
「特許法第13条 特許を受けることができない発明」
(1)次に掲げるものは、それが第12条の意味における発明であるという事実があったとしても、特許を受けることができない。」
(略)
(d)人間又は動物の身体についての外科術又は治療術による処置の方法及び人間又は動物の身体に施される診断方法 ただし、本項は、前記方法において使用される製品には適用しないものとする。
「第14条 新規性」
(4) (2)の規定は、先行技術に含まれる物質又は組成物の、第13 条(1)(d)にいう方法における使用に関する特許性を排除するものではない。ただし、そのような方法におけるその使用が先行技術に含まれていないことを条件とする。
「特許審査基準 第4章 特許性 3.特許を受けることができない発明」
3.5 人間又は動物の身体についての外科術又は治療術による処置の方法及び人間又は動物の身体に施される診断方法
本規定は、当該方法に使用される製品には適用されない。従って、当該方法における使用のための外科術、治療術又は診断の器具又は装置について特許を取得することができる。~~~。
外科術、治療術、及び/又は診断方法における第一用途についての既知の物質又は組成物へのクレームは、次のような様式でなければならない:「物質又は組成物X」の後に使用の表示を続ける。例えば、「..薬としての使用について」、「..抗菌薬として」又は「..疾病Yの治療について」である。~~~。
「治療用途Zのための薬を製造するための物質又は組成物の使用」の様式でのクレームは、最初か又は「後の」(第2以降の当該出願の何れかについて、その出願が新規かつ進歩性を有することを条件として認められる。
(2-5)シンガポール
シンガポールでは、用途発明、医薬用途発明ともに発明の保護対象として認められています。具体的には、「用途発明」について発明の保護対象から特段除外されていません。「医薬用途発明」については、審査ガイドライン第8章 8によれば、スイスクレームで表現される場合にのみ特許の対象となり得ることが規定されています。
8 特許可能な主題及び産業上の利用可能性
D. 医薬用途
ii. 第二医薬用途
8.138 物質若しくは組成物の第二又はそれ以降の医薬用途は「スイスタイプ」クレームの形式でのみ クレームに記載することができる。~~~。
8.139 「スイスタイプ」クレームは、特定の医薬用途の薬剤を製造するための物質の使用を対象とした、目的限定の方法クレームとみなされる。よって「スイスタイプ」クレームは、物質若しくは 組成物の第二又はそれ以降の医薬用途に制限されず、組成物の第一医薬用途が既知のものでない場合でも使用することができる。
(2-6)フィリピン
フィリピンでは、用途発明、医薬用途発明ともに発明の保護対象として認められるようです。具体的には、知的財産法において特許を受けることができない発明が挙げられていますが、「新たな用途の発見にすぎないものではなく、実用的な用途が見出されること」で保護が認められます。より具体的には、既知物質を含む医薬関連出願の改訂審査ガイドライン(QUAMAガイド)に沿って審査が行われます。
「知的財産法第22条 特許を受けることができない発明」
次のものは特許による保護から除外される。
22.1 発見、科学の理論及び数学の方法並びに薬剤製品に関して、既知物質の新たな形式若しくは性質であって、当該物質の既知の効力の向上をもたらさないものの発見にすぎないもの、既知物質の何らかの新たな性質若しくは新たな用途の発見にすぎないもの、又は既知方法の使用にすぎないもの。ただし、当該既知方法が少なくとも一種の新たな反応物を含む新たな製品を製造できる場合はこの限りではない。
本条において、既知物質の塩、エステル、エテール849、多形体、代謝物、純物質、粒度、異性体、異性体混合物、複体、結合体及び他の誘導体は、同じ物質であるものとする。ただし、効力の点で顕著な相違を有する物質はこの限りではない。
22.3 手術又は治療による人体又は動物の体の処置方法及び人体又は動物の体の診断方法。本規定は、それらの方法の何れかにおいて使用するための物及び組成物には適用しない。
「既知物質を含む医薬関連出願の改訂審査ガイドライン」
1.INTRODUCTION 5.2 医薬用途クレーム
法第22.3条の除外が適用されるのは、明記されているように、処置方法及び診断方法のみであって、それらの方法において使用する物及び組成物には適用されない。よって、処置方法又は診断方法で使用するための物及び組成物、特に物質又は組成物に関する特許を得ることは可能である。
したがって、本規定は物又は組成物の医薬用途に対する特許保護を、明示的に認めるものである。物質の医薬用途に対する特許保護の目的で、クレームに記載された用途が、特許保護を受けられる発明とみなされるには、何らかの病状を明確かつ実際に治療する形での、実用的な用途が見出されることが必要である。
5.2.2 第二医薬用途クレーム
第二医薬用途クレームが含まれる出願を評価する際は、QUAMA規定の範囲内で、どのように第二医薬用途が提示されているかを理解することが重要である。
Xを使用してYを治療するというような、特許性のない治療方法のクレームが出願に含まれている場合、これらのクレームを補正して、第二医薬用途クレームの形式に変えることは追加事項にはならないため、審査段階ではいつでも認められる。
ある治療用途がさらなる医薬用途と見なされるためには、既知物質の新たな技術的効果が、異なる病状の治療となる、真に新しい治療用途につながるものでなければならないことに、審査官は留意すべきである。
(小括)
留意すべき点としましては、アセアン主要6カ国のうち、日系企業による進出が多いとされるタイ、ベトナム、インドネシアにおいて用途発明(医薬用途発明)が保護対象として(ほぼ)認められない、認められるか不確定といった状態であることです。
この点について、日本を含む諸外国から、特に医薬用途発明の保護を認めるためのロビー活動がなされていますが、一筋縄ではいかないようです。特に、ベトナムでは、特許規則で保護対象から明確に除外することを規定しており、今後も保護することは難しいと考えます。タイでは、用途発明の保護について規定がないところ、タイ政府が現地NGO団体からの反対を押し切ることは難しい印象です。他方で、インドネシアでは、知財庁が新たな特許審査ガイドラインを発行しており、実務上では未だ不確定ではあるものの、今後の医薬用途発明の保護に向けた動きが期待されます。
3.最後に
以上、アセアン主要6カ国(タイ、インドネシア、ベトナム、マレーシア、シンガポール、フィリピン)における「用途発明(医薬用途発明)の保護の取り扱い」について説明しました。
日系企業が東南アジアに進出するにあたって、用途発明(医薬用途発明)が保護されないことは、特に医薬・バイオ・食品分野等において今後に問題になってくるものと考えます。
現地の法律や規則、ガイドラインの改正情報、判例情報等を通じて、今後に用途発明が保護され得るとしたらどのような手続を取るべきか等、最新情報を得られるようにしておくことが望ましいです。
以上、今回の知財実務に関する情報がご参考になればと思います。
なお、新興国等知財データバンクHPに、タイ、インドネシア、ベトナム、マレーシア、シンガポール、フィリピンにおける「医薬用途発明の保護制度」が挙げられています。また、特許庁のHPに「ASEAN各国の知財政策及びIP5等からの知財協力の現状に関する調査研究」が挙げられています。こちらもご参考にしてください。

石川 勇介(弁理士、元ジェトロ・バンコク事務所)
専門分野:特許権利化実務(化学/材料/機械/ソフトウェア/ビジネスモデル)、特許調査
秋山国際特許商標事務所 https://www.tectra.jp/akiyama-patent/